Los investigadores de la FDA están estudiando el uso de biomarcadores farmacodinámicos (PD) para demostrar la biosimilitud. Estos estudios podrían hacer más eficaz y rápido el proceso de desarrollo de biosimilares.
Los productos biosimilares son muy similares a los productos de referencia aprobados por la FDA, sin diferencias clínicas significativas. Pueden aportar competencia y tratamientos más asequibles. La FDA y las partes interesadas están trabajando en la racionalización de los estudios clínicos para facilitar el desarrollo eficiente de biosimilares.
En la actualidad, la mayoría de las aprobaciones de biosimilares requieren datos de similitud farmacocinética (PK) (datos sobre cómo el cuerpo absorbe, distribuye, metaboliza y excreta un producto) y estudios clínicos comparativos (un estudio mediante el cual los investigadores comparan el biosimilar y el producto de referencia utilizando criterios de valoración clínicos en una población de pacientes), lo que generalmente lleva mucho tiempo, es costoso y requiere un gran número de participantes.
Sin embargo, un enfoque más racionalizado consistiría en presentar datos de similitud PK y PD (datos sobre la relación entre la exposición al fármaco, como los niveles de dosificación, y la respuesta posterior del organismo) junto con datos comparativos de seguridad e inmunogenicidad, recopilados a partir de estudios más breves y menos costosos. Así, los biosimilares podrían aprobarse basándose en datos de biomarcadores de PK y PD sin un estudio comparativo de eficacia clínica [1].
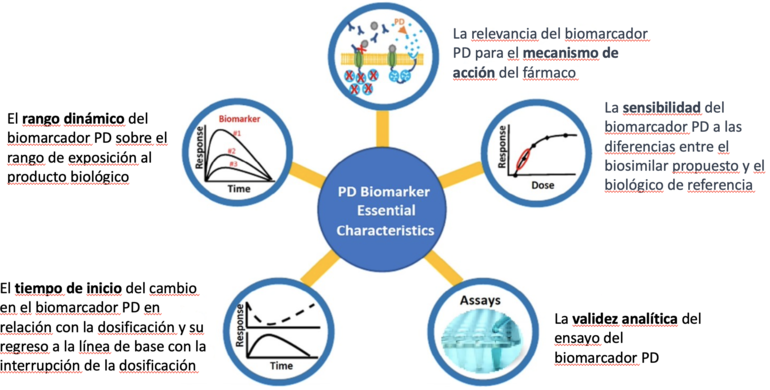
La FDA ha descrito (ver Figura 1) cinco características esenciales de un biomarcador de PD para biosimilares para ayudar a los patrocinadores que planean usar biomarcadores de PD en el desarrollo de biosimilares [2].
Figura 1: Características de los biomarcadores PD
La FDA ha estado llevando a cabo investigación aplicada sobre biomarcadores de PD para ayudar en el desarrollo de biosimilares, como se indica en el Plan de Acción de Biosimilares de 2018 (2018 Biosimilars Action Plan en inglés). Esta investigación implica estudios de farmacología clínica en los que se administró a los participantes dosis variables de un biológico y se evaluó la respuesta de los biomarcadores. Los biomarcadores que muestran una relación entre la dosis y la respuesta pueden ser adecuados para un estudio de similitud de PD.
La FDA e investigadores externos han identificado y evaluado biomarcadores utilizando tecnologías avanzadas y simulaciones en estudios controlados con placebo, que se publicaron en el número de enero de 2023 de Clinical Pharmacology and Therapeutics.
La investigación ha sido realizada por la FDA sobre biomarcadores en las siguientes cuatro clases de biológicos [3]:
- Inhibidores de PCSK9 (medicamentos para el colesterol)
- Antagonistas de la IL-5 (medicamentos para el asma)
- Proteómica para identificar biomarcadores de IFNβ-1a (Medicamentos para la esclerosis múltiple)
- Enfoque basado en modelos para la selección de dosis de pegfilgrastim (Medicamentos de apoyo para el cáncer).
La investigación de la FDA ha proporcionado nuevas perspectivas sobre el análisis de datos de biomarcadores de PD, ha mejorado nuestra comprensión de las consideraciones bioanalíticas del análisis de los criterios de valoración de PK y PD, y ha ilustrado cómo las técnicas "ómicas" emergentes pueden ayudar a reconocer biomarcadores potenciales de PD para el desarrollo de biosimilares.
Artículos relacionados
The ‘positioning’ of PD biomarkers in evaluating biosimilarity
PD biomarkers for biosimilar development and approval
FDA to investigate PD biomarkers to show biosimilarity
|
FORO LATINOAMERICANO
Se ha lanzado la nueva sección del ‘Foro Latinoamericano’ sobre GaBI. El objetivo de esta nueva sección es brindarle las últimas noticias y actualizaciones sobre desarrollos de medicamentos genéricos y biosimilares en América Latina en español. Ver el último artículo de cabecera: Avanzar en el desarrollo de medicamentos biosimilares con biomarcadores farmacodinámicos !Explore las noticias en el Foro Latinoamericano! Regístrese para recibir el boletín informativo GaBI Foro Latinoamericano. Informe a colegas y amigos sobre esta nueva iniciativa.
|
Referencias
1. GaBI Online - Generics and Biosimilars Initiative. The role of PD biomarkers in biosimilarity [www.gabionline.net]. Mol, Belgium: Pro Pharma Communications International; [cited 2023 Apr 27]. Available from: www.gabionline.net/reports/the-role-of-pd-biomarkers-in-biosimilarity
2. GaBI Online - Generics and Biosimilars Initiative. Key considerations for PD biomarkers in evaluating biosimilarity [www.gabionline.net]. Mol, Belgium: Pro Pharma Communications International; [cited 2023 Apr 27]. Available from:
www.gabionline.net/reports/key-considerations-for-pd-biomarkers-in-evaluating-biosimilarity
3. Strauss DG, Wang YM, Florian J, et al. Pharmacodynamic Biomarkers Evidentiary Considerations for Biosimilar Development and Approval. Clin Pharmacol Ther. 2023, 55-61. doi:10.1002/cpt.2761.
4. Innovations in Biosimilars. Clin Pharmacol Ther. 2023;113(1):1-195. doi.org/10.1002/cpt.2653
Permiso otorgado para reproducir solo para uso personal y no comercial. Cualquier otra reproducción, copia o reimpresión de todo o parte de cualquier "Contenido" que se encuentre en este sitio web está estrictamente prohibida sin el consentimiento previo del editor. Póngase en contacto con el editor para obtener permiso antes de redistribuir.
Copyright – a menos que se indique lo contrario, todo el contenido de este sitio web es © 2023 Pro Pharma Communications International. Todos los derechos reservados.








 0
0










Post your comment